- Index
- >Actualités
- >Friday Seminar
Les Friday Seminars, c'est quoi ?
Venez nombreux assister au Friday Seminar !
Ces présentations orales durant la pause du midi le vendredi sont l'occasion de mettre à l'honneur les avancées majeures des équipes de recherche Angevines ou des plateformes de la SFR ICAT.
Chaque Friday Seminar, un laboratoire attaché à la SFR ICAT donne la parole à un collaborateur pour exposer ses travaux de recherche ou à l'un de ses chercheurs, ingénieurs ou étudiants.
Une occasion en or pour découvrir la recherche du pôle Angevin, pour échanger autour de diverses thématiques de recherche et rencontrer des personnalités extérieures qui font la recherche de demain !
Prochain séminaire :

Dialogue inter-organes : la lipolyse du tissu adipeux contrôle le métabolisme hépatique et la sécrétion d'insuline
Le 6 mars 2026
Date : vendredi 6 mars 2026
Lieu : salle de réunion IBS-IRIS1, RdC Horaire : 12h00
Dr Pierre-Damien DENECHAUD
CRCN chez Inserm UMR1048 - I2MC - Institut des Maladies Métaboliques et Cardiovasculaires, Toulouse
Dialogue inter-organes : la lipolyse du tissu adipeux contrôle le métabolisme hépatique et la sécrétion d'insuline
Chez les mammifères, le maintien de l’homéostasie glucido-lipidique est crucial, il permet l’adaptation de l'organisme aux grandes variations d’apport et d’utilisation énergétiques. Cela nécessite une régulation fine des voies métaboliques avec une coordination entre les organes tels que le tissu adipeux, le foie et le pancréas. Dans ce dialogue inter-organes, nous pensons que le tissu adipeux est joue un rôle central, notamment en contrôlant la libération des stocks lipidiques par la voie de la lipolyse. Les étapes limitantes de cette voie sont effectuées par les lipases ATGL (adipose triglyceride lipase) et HSL (hormone sensitive lipase).
Pour répondre à cette hypothèse, nous avons développé au laboratoire des modèles de souris dans lesquels les lipases ATGL et HSL ont été invalidées spécifiquement dans les adipocytes (conduisant à une invalidation partielle ou totale de la lipolyse adipocytaire). De manière intéressante, nous avons observé que la lipolyse adipocytaire participait au contrôle transcriptionnel du foie et au développement de la stéatose hépatique. De plus, nos résultats montrent que la lipolyse adipocytaire contrôle également la sécrétion d'insuline, ce qui souligne l'importance du dialogue inter-organes entre le tissu adipeux et le pancréas endocrine.
En somme, nos études mettent en évidence le rôle fondamental de la lipolyse adipocytaire, non seulement en tant que fournisseur de substrats énergétiques, mais aussi en tant que régulateur métabolique et hormonal majeur, notamment du foie et du pancréas endocrine. Cela ouvre de nouvelles perspectives sur les fonctions du tissu adipeux et suggère que la modulation pharmacologique de la lipolyse pourrait représenter une cible thérapeutique pertinente pour traiter les troubles métaboliques, tels que le diabète et les hépatopathies (MAFLD).
Séminaires précédents :

La science illustrée par un scientifique : Présentation de Laboratory Artwork, un service d’illustration scientifique et de vulgarisation proposé par un docteur en biologie
Le 9 janvier 2026
Date : vendredi 9 janvier 2026
Lieu : Amphithéâtre ICO Horaire : 12h00
Dr Arthur Planul
Laboratory Artwork
La science illustrée par un scientifique : Présentation de Laboratory Artwork, un service d’illustration scientifique et de vulgarisation proposé par un docteur en biologie
Après avoir fait des études en neurosciences, j’ai réalisé ma thèse intitulée « Évolution dirigée de virus adéno-associés pour un transfert de gènes efficace dans le système visuel » à l’Institut de la Vision et je l’ai soutenue en 2017. Curieux de nature, je me suis ensuite reconverti en tant que développeur logiciel, jusqu’à ce que l’appel de la biologie et de la science en général soit trop grand. C’est pourquoi je me suis lancé dans l’aventure de Laboratory Artwork en avril 2025. Je propose aussi bien des schémas à la demande pour un besoin ponctuel (article, poster, présentation, demande de financement…), qu’une collaboration plus étroite tout le long de votre projet d’illustration, que celui-ci s’adresse aux acteurs de la science ou bien au grand public.
Mitochondria morphology/function across species and aging
Le 19 décembre 2025
Annulé
Date : vendredi 19 décembre 2025
Lieu : Amphithéâtre ICO Horaire : 12h00
Dr Jean-Philippe Pradère, PhD
CRCN Inserm, Institut RESTORE, Equipe 3 Métabolink, UMR 1301- Inserm/5070-CNRS/EFS/Univ. P. Sabatier, Toulouse
Mitochondria morphology/function across species and aging
We aim to study mitochondria heterogeneity in several tissues clinically related to aging especially blood and skeletal muscles. We investigated whether mitochondria size heterogeneity is related to ultrastructural heterogeneity and associated with mitochondria dysfunctions. Based on morphological studies on multiple model organisms and patients - using a home-made methodology EMito-Metrix- we demonstrate that muscle mitochondria morphology shows a broad diversity across species, with pronounced morphological changes upon aging, which can support successful prediction of chronological age using Machine learning models.
Reference: Morin E, et al., EMito-Metrix enables automated evaluation of mitochondrial morphology across species. Nature Metabolism. 2025 Nov;7(11):2179-2182. PMID: 41094017.
Du CO₂ à la santé publique : mesurer et comprendre l’impact du changement climatique
Le 12 décembre 2025
Date : vendredi 12 décembre 2025
Lieu : Amphithéâtre ICO Horaire : 12h00
Dr Marie Bonnin
Enseignante-chercheuse Université d'Angers, Polytech Angers, Laboratoire de Micro et Nanomédecines Translationnelles (MINT)
Chargées de mission Transition écologique
Du CO₂ à la santé publique : mesurer et comprendre l’impact du changement climatique
Présentation sur le thème des émissions de gaz à effet serre et du changement climatique et son impact sur la santé :
- Comment on calcul des émissions en CO2 équivalent à partir des émissions de différents gaz à effet de serre,
- Outil qui permet de faire le bilan gaz à effet de serre d'un laboratoire de recherche avec en illustration les résultats de ;MINT,
- Lien entre le changement climatique et la santé.
Rôle du signal calcique mitochondrial dans le cancer colorectal : de la reprogrammation métabolique à la modulation de la réponse immunitaire antitumorale
Le 21 novembre 2025
Date : vendredi 21 novembre 2025
Lieu : Amphithéâtre Salle de conférence RdC IBS-IRIS1 Horaire : 12h00
Dr Maxime Gueguinou
UMR Inserm U 1069 - Niche, Nutrition, Cancer et métabolisme Oxydatif (N2COx) de Tours
Rôle du signal calcique mitochondrial dans le cancer colorectal : de la reprogrammation métabolique à la modulation de la réponse immunitaire antitumorale
Le calcium (Ca²⁺) constitue un second messager universel régulant des processus cellulaires fondamentaux tels que la prolifération, la migration, la mort cellulaire et la réponse immunitaire, autant de mécanismes centraux dans le développement du cancer. Au cours des dernières décennies, la dérégulation de l'homéostasie calcique est apparue comme une force motrice importante dans l'initiation et la progression des pathologies malignes, notamment au niveau du réticulum endoplasmique (RE) et des mitochondries. Le dialogue calcique entre le RE et les mitochondries s'établit dans un domaine membranaire spécialisé appelé mitochondria-associated membrane, qui contrôle l'homéostasie cellulaire. Dans les cellules cancéreuses, ce dialogue est profondément remanié, favorisant la transformation mésenchymateuse, la migration, les métastases, l'autophagie et la résistance à l'apoptose, obstacle majeur aux traitements thérapeutiques actuels. Au-delà de leur rôle dans la production d'énergie cellulaire, les mitochondries constituent des régulateurs majeurs de la carcinogenèse en modulant la production d'ATP, l'équilibre entre métabolismes glycolytique et oxydatif, ainsi que la prolifération et la mort cellulaire. Ces altérations métaboliques des cellules tumorales influencent profondément le microenvironnement tumoral en modifiant la disponibilité des nutriments, des métabolites et du pH, affectant ainsi le métabolisme et les fonctions effectrices des cellules immunitaires péri-tumorales. La signalisation calcique mitochondriale est orchestrée principalement par l'uniporteur calcique mitochondrial (MCU) qui assure l'entrée de Ca²⁺ dans la matrice mitochondriale, et par les échangeurs NCLX et TMEM65 qui en contrôlent l'efflux. Nos recherches visent à explorer le rôle de ces acteurs calciques mitochondriaux dans les différentes étapes de la carcinogenèse colique et leur impact sur la reprogrammation métabolique tumorale. De manière critique, la signalisation calcique mitochondriale influence également les cellules immunitaires Les métabolites dérivés des tumeurs suite à l'altération de la signalisation calcique mitochondriale créent des niches immunosuppressives qui atténuent les réponses immunitaires et favorisent la polarisation des macrophages associés aux tumeurs vers des phénotypes immunosuppresseurs. Cette présentation exposera comment le ciblage de la signalisation calcique mitochondriale offre une stratégie thérapeutique innovante à double action : impacter directement le métabolisme des cellules cancéreuses tout en reprogrammant le microenvironnement immunitaire pour potentialiser l'efficacité de la réponse immunitaire antitumorale.
De l’échelle globale à l’échelle locale : logistique du transport du calcium au cours de la minéralisation osseuse embryonnaire
Le 7 novembre 2025
Date : vendredi 7 novembre 025
Lieu : Amphithéâtre IBS-IRIS, salle du rez-de-chaussée Horaire : 12h00
Dr Emeline Raguin
Group Leader Biomaterials, Development of Mineralized Skeletal Materials, Max Planck Institute of Colloids and Interfaces, Potsdam, Germany
De l’échelle globale à l’échelle locale : logistique du transport du calcium au cours de la minéralisation osseuse embryonnaire
La formation osseuse embryonnaire repose sur un apport massif et continu de calcium, qui doit être transféré efficacement jusqu’aux sites de minéralisation de la matrice extracellulaire. Si les mécanismes moléculaires de la minéralisation sont relativement bien décrits, la dynamique cellulaire et subcellulaire du transport des précurseurs minéraux durant le développement reste largement méconnue. Dans ce contexte, le développement du fémur de la caille a été étudié à l’aide d’une approche multi-échelle permettant de comparer les dimensions tissulaire, cellulaire et subcellulaire. À l’échelle globale, la micro-tomographie (micro-CT) a permis de quantifier la croissance osseuse à différents jours embryonnaires et d’estimer la densité des cellules ostéocytaires. À l’échelle locale, la microscopie électronique à faisceau d’ions focalisé en conditions cryogéniques (cryo-FIBSEM) a révélé en trois dimensions, dans un état proche du natif, la présence de vésicules intracellulaires contenant des précurseurs minéraux, au sein de cellules osseuses actives. La quantification de ces vésicules et leur mise en relation avec les données issues du micro-CT a permis de proposer un modèle logistique de transport calcique. Au niveau local, les observations suggèrent que les cellules osseuses libèrent des vésicules de manière active et à un rythme soutenu, similaire entre les différents âges embryonnaires étudiés. En revanche, à l’échelle globale, la forte augmentation du volume osseux mesuré indique que l’accélération de la minéralisation résulte principalement de la prolifération des cellules. Cette approche intégrative souligne la complémentarité des mécanismes locaux et globaux et met en évidence le rôle déterminant de la dynamique cellulaire dans la formation osseuse embryonnaire.
The Roles of Topoisomerases in Extranuclear DNA Maintenance
Le 10 octobre 2025
Date : vendredi 10 octobre 2025
Lieu : Amphithéâtre IBS-IRIS, salle du rez-de-chaussée Horaire : 12h00
Dr Ilaria Dalla Rosa
Principal Research Scientist at The Francis Crick Institute, London, England, United Kingdom
The Roles of Topoisomerases in Extranuclear DNA Maintenance
Topoisomerases are essential enzymes that regulate the topological state of DNA molecules. By transiently breaking and rejoining DNA strands, they relieve supercoiling, untangle knots, and resolve DNA catenanes, topological challenges that arise during critical cellular processes such as DNA replication, transcription, and chromosome segregation. While traditionally studied for their vital roles in maintaining nuclear genome integrity, topoisomerases also function beyond the nucleus. They play key roles in preserving the integrity of extranuclear genomes, including mitochondrial DNA and the viral genomes of poxviruses that replicate within the cytoplasm of infected cells. This talk will explore how these nuclear enzymes are recruited to extranuclear DNA replication sites and how their activities contribute to the faithful propagation and maintenance of mitochondrial and viral genomes.
Olfaction et contrôle de la glycémie : un rôle pour le circuit du GLP-1 dans le bulbe olfactif
Le 3 octobre 2025
Date : vendredi 3 octobre 2025
Lieu : IBS-IRIS, salle du rez-de-chaussée Horaire : 12h00
Pr Christophe Magnan
Professeur Université Paris Cité, BFA Unit, CNRS UMR 8251
Olfaction et contrôle de la glycémie : un rôle pour le circuit du GLP-1 dans le bulbe olfactif
L’olfaction et la détection des odeurs alimentaire joue un rôle physiologique dans le contrôle de la balance énergétique et notamment la sécrétion d’insuline et la régulation de la glycémie. Les neurones du bulbe olfactif expriment les principaux récepteurs aux hormones « métabolique » comme l’insuline, la leptine ou le GLP-1. Ce séminaire sera principalement centré sur le rôle du circuit GLP-1 dans le bulbe olfactif et le contrôle de la sécrétion et l’action de l’insuline via des relais hypothalamiques et le système nerveux autonome.
christophe.magnan@univ-paris-diderot.fr
Accès aux soins primaires : des défis contemporains au Québec
Le 20 juin 2025
Date : vendredi 20 juin 2025
Lieu : Amphithéâtre ICO Horaire : 12h00
Dr Mylaine Breton
Chaire de recherche du Canada en gouvernance clinique des services de première ligne
Professeure titulaire, Département des sciences de la santé communautaire
L’accès à des soins primaires sont un ingrédient essentiel à des systèmes de santé performants. L’affiliation à un médecin généraliste et l’accès en temps opportun sont deux dimensions de l’accès. Le Canada et particulièrement le Québec, sont parmi les pires pays au monde sur ces deux dimensions. Cette présentation vise à présenter deux innovations organisationnelles pour répondre à cette problématique; les guichets d’accès aux patients orphelins et le modèle d’accès adapté.
Mylaine.Breton@usherbrooke.ca
From metabolic (de) regulation to (mis)wiring of the brain
Le 13 juin 2025
Date : vendredi 13 juin 2025
Lieu : Amphithéâtre Rez-de-chaussée IBS Horaire : 12h00
Dr Julien Courchet
Directeur de Recherche (DR2) Inserm, Pathophysiology and genetics of neuron and muscle (PGNM), Institut NeuroMyoGene - CNRS UMR5261 - Inserm U1315, Université Claude Bernard - Lyon I
The correct patterning of long-range axonal connections relies on the coordinated activation of cell-intrinsic signaling pathways in response to environmental cues such as trophic factors, guidance molecules and synaptic activity. The kinase LKB1 has been linked to several aspects of axon development through the sequential activation of intracellular signaling pathways involving AMPK and related kinases. We previously identified that LKB1 regulates axon outgrowth and terminal branching through the activation of NUAK1, an AMPK-related kinase whose mutations are associated to ASD and other neurodevelopmental disorders. NUAK1, but not AMPK, regulates axonal mitochondria trafficking and metabolic activity to support axonal branching. We furthermore uncovered that NUAK1 has a novel function in the regulation of neuronal alternative splicing and identified targets linking gene expression and mitochondrial metabolism. Especially, NUAK1 controls the expression of BRAWNIN, a mitochondrial microprotein whose function is necessary and sufficient to support axon branching. We finally describe the LKB1/NUAK1 axis as an integrator of extracellular cues controlling axon branching, providing neural correlates to behavioral alterations found in LKB1- and NUAK1-deficient mice. Overall, our results suggest that LKB1 integrates extracellular signals to adapt axon branching to the local cellular context and suggest that a local regulation of metabolic activity participates in the balance between short and long-range axonal projections.
julien.courchet@univ-lyon1.fr
Quantitative Imaging of the Cell
Le 23 mai 2025
Date : vendredi 23 mai 2025
Lieu : Amphithéâtre ICO Horaire : 12h00
Dr Jean-Baptiste SIBARITA
Research Engineer, CNRS, Group leader team Quantitative Imaging of the Cell, Interdisciplinary Institute for Neuroscience, Université de Bordeaux
JB Sibarita has a PhD thesis in Physics and is expert in live cell microscopy and image analysis. He has co-headed and developed the “Cellular and Tissular Imaging Platform” of the Institut Curie, Paris, for 12 years. In 2009, he created his CNRS R&D team “Quantitative Imaging of the Cell” in the newly created Interdisciplinary Institute of Neuroscience, in Bordeaux. Together with the physicists, computer scientists and biologists within the team, they aim at developing novel quantitative imaging techniques to decipher the living cell activity at various spatial and temporal scales, in a high throughput context. In 2018, he spent a year at the National University of Singapore to co-develop the single objective light-sheet microscope in the context of 3D cell culture.
During the last 15 years, JB Sibarita has initiated several academic and industrial partnerships, based on the developments achieved in his lab. He is co-author of more than 100 peer review publications, some amongst the most prestigious journals (Nature, Nature Methods, Neuron, Nature Comm, etc…). He is at the origin of 5 industrial technology transfers as single or main author and 3 patents. He was awarded with the CNRS crystal medal in 2006 and obtained a chaire d’excellence of the Regional Council of Aquitaine in 2009.
jean-baptiste.sibarita @ u-bordeaux.fr
Phone: +33-(0)5 33 51 47 06
www.iins.u-bordeaux.fr/TEAM-SIBARITA
References :
- Choquet D, Sainlos M, Sibarita JB, “Advanced imaging and labelling methods to decipher brain cell organization and function”. Nat Rev Neurosci (2021) https://doi.org/10.1038/s41583-021-00441-z
- Beghin A, Grenci G, Sahni G, Guo S, Rajendiran H, Delaire T, Mohamad Raffi SB, Blanc D, de Mets R, Ong HT, Galindo X, Monet A, Acharya V, Racine V, Levet F, Galland R, Sibarita JB, Viasnoff V, “Automated high-speed 3D imaging of organoid cultures with multi-scale phenotypic quantification”. Nat Methods (2022) https://doi.org/10.1038/s41592-022-01508-0
- Levet F, Sibarita JB, “PoCA: a software platform for point cloud data visualization and quantification”. Nat Methods (2023) https://doi.org/10.1038/s41592-023-01811-4
- Roos J, Bancelin S, Delaire T, Wilhelmi A, Levet F, Engelhardt M, Viasnoff V, Galland R, Nagerl UV, Sibarita JB, “Arkitekt: streaming analysis and real-time workflows for microscopy”. Nat Methods (2024) https://doi.org/10.1038/s41592-024-02404-5
POPS - La santé au travail en médecine générale
Le 25 avril 2025
Date : vendredi 25 avril 2025
Lieu : Amphithéâtre ICO Horaire : 12h00
Dr Cyril Begue
Laboratoire POPS, MCF médecine générale - Département de Médecine Générale
Les problématiques de santé au travail sont fréquemment rencontrées par les médecins généralistes mais elles sont peu étudiées dans ce contexte. Utilisant différentes méthodologies (quantitatives, qualitatives, mixtes et revue de littérature) j’ai pu étudier des pathologies liées au travail comme la souffrance psychique au travail ou les lombalgies. Cela m’a amené à m’intéresser à des thématiques plus transversales telles que la prescription d’arrêt de travail, le maintien en emploi et la collaboration avec les médecins du travail et les médecins conseils. Cet axe de recherche permet également de faire le lien avec mes activités de cliniciens et d’enseignant.
Mitochondrial Plasticity: Therapeutic and Diagnostic Opportunities
Le 15 avril 2025
Date : mardi 15 avril 2025
Lieu : Amphithéâtre ICO Horaire : 12h00
Dr Rodrigue Rossignol
Director of Research – INSERM / MRGM, UMR 121 "Rare diseases, metabolism and genetics", Université de Bordeaux
Mitochondrial Plasticity: Therapeutic and Diagnostic Opportunities
Abstract: Mitochondria perform numerous biochemical functions such as energy transduction, lipid and vitamin synthesis, and detoxification. These organelles adapt to the constraints of the human body and to environmental stresses by modifying their composition and structure, including the biochemical pathways of catabolism and anabolism. This plasticity endows mitochondria with a remarkable adaptive capacity, and our INSERM U1211 team studies the genetic and proteomic mechanisms underlying mitochondrial plasticity. To do this, we analyze the molecular changes in mitochondria in pathological situations, during energy crises, or upon exposure to environmental toxins. Our work has led to the identification of signaling pathways involved in the toxicity of tobacco smoke and has shed light on the role of mitochondrial proteostasis in rare developmental diseases. The understanding of these “mitoplasticity” mechanisms is leveraged to develop preclinical drug development approaches within the “CELLOMET” technological platform and at the start-up ANKIAL, a spin-off of our INSERM research unit. In this presentation, I will discuss our translational approach that spans from physiopathological and fundamental research on mitochondrial plasticity to technology transfer for diagnostic and medical applications in the field of energy metabolism.
Five references :
- Repression of oxidative phosphorylation by NR2F2, MTERF3 and GDF15 in human skin under high-glucose stress. Ley-Ngardigal S. et al. Redox Biology 2025 (in press)
- HRAS germline mutations impair LKB1/AMPK signaling and mitochondrial homeostasis in Costello syndrome models. Dard L. et al. J Clin Invest. 2022 Apr 15;132(8):e131053.
- Targeting the mitochondrial trifunctional protein restrains tumor growth in oxidative lung carcinomas. Amoedo ND. et al. J Clin Invest. 2021 Jan 4;131(1):e133081.
- Targeting Human Lung Adenocarcinoma with a Suppressor of Mitochondrial Superoxide Production. Dias Amoedo N. et al. Antioxid Redox Signal. 2020 Nov 1;33(13):883-902.
- Nuclear control of lung cancer cells migration, invasion and bioenergetics by eukaryotic translation initiation factor 3F. Esteves P et al. Oncogene. 2019 Sep 16.
Conférence de Felix Sauvage
Le 28 février 2025
Date : vendredi 28 février 2025
Lieu : Amphithéâtre ICO Horaire : 12h00
Dr Felix Sauvage
Associate professor at Ghent University in the group of Stefaan De Smedt.
Lasers have revolutionized diagnosis and therapy in ophthalmology, offering precision and efficacy in addressing a wide range of conditions. By combining light-absorbing or plasmonic nanoparticles with pulsed-laser irradiation, photothermal effects can be generated and strategically applied for therapeutic purposes, such as delivering compounds into cells or ablating “eye floaters” (vitreous opacities). Upon pulsed-laser irradiation, light-absorbing or plasmonic nanoparticles rapidly heat up, causing the evaporation of surrounding water. This process leads to the formation of vapor nanobubbles (VNBs), which undergo rapid expansion and collapse. The mechanical forces generated during the collapse of VNBs can be harnessed for diverse biomedical applications. In our work, we are investigating these forces for: (i) creating transient pores in the plasma membranes of cells (“photoporation”) to facilitate the direct delivery of therapeutic cargos into the cytosol, (ii) ablating vitreous opacities to improve vision, and (iii) selectively ablating cancer cells located on the surface of the eye.These effects can be achieved using different types of nanoparticles, such as gold, polydopamine, or iron oxide nanoparticles, at a lower laser fluence (<4.5 J/cm²) than is currently employed in clinical settings with pulsed lasers.
Felix.Sauvage@UGent.be
Smart Polyoxazoline Platform for Drug Delivery Systems Modeling
Le 24 janvier 2025
Date : vendredi 24 janvier2025
Lieu : Amphithéâtre ICO Horaire : 12h00
Oksana Krupka
Université d'Angers, Inserm, CNRS , MINT, SFR ICAT, F-49000 Angers, France
Smart Polyoxazoline Platform for Drug Delivery Systems Modeling
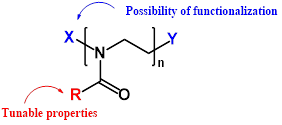
Poly(2-alkyl-2-oxazoline)s (POx) have been attracting attention of researchers due to their possibility to combine biocompatibility with stealth behavior, making them ideal candidates for use in a wide variety of biomedical applications and makes them a valuable alternative to poly(ethylene glycol).
The polyoxazolines (POx) was investigated as perspective versatile multi-functional materials for DDS. We have shown different approaches for the use of smart polymers with different architectures for use in nanomedicine for imaging, theranostics, diagnostics, and drug delivery systems.
e-mail: oksana.krupka @ univ-angers.fr
Save the date
- 3 octobre 2025 : Christophe Magnan, invité par MitoVasc RMeS
- 10 octobre 2025 : Ilaria Dalla Rosa, invitée par MitoVasc
- 7 novembre 2025 : Emeline Raguin, invitée par RMeS
- 21 novembre 2025 : Maxime Gueguinou, invité par MitoVasc
- 12 décembre 2025 : Marie Bonnin, Universtié d'Angers
- 19 décembre 2025, Jean-Philippe Pradère, invité par HIFIH/MitoVasc
- 9 janvier 2026 : Arthur Planul, Illustrateur scientifique
- 13 février 2026 : intervenant non identifié
- 6 mars 2026 : Pierre-Damien DENECHAUD, Invité par EV-Link, HIFIH
- 13 mars 2026 : BD Cytométrie spectrale, invité CRCI2NA eq4
- 10 avril 2026 : Thomas Fischer, invité CRCI2NA eq4
- 22 mai 2026 : intervenant non identifié
- 19 juin 2026 : intervenant non identifié